【化學】責任編輯群介紹
化學責任編輯
化學責任編輯
化學教室活動:製作磁性異形(How to Make Magnetic Alien)〔II〕
國立大甲高級中學化學科廖旭茂老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師指引(Teacher’s Guide)
教學提示
1. 切記四氧化三鐵不可添加過量,否則不易攪拌均勻,易發生疙瘩狀的結塊。
2. 飽和的硼砂水溶液切勿添加太快或過量,否則「異形」會太Q或太硬,影響強力磁鐵的操作的效果。
3. 製作完成的磁力異形請務必放置入可密封的塑膠瓶中,以防水分蒸發,甚至乾掉硬化。
4. 製作磁力異形時,必須攪拌均勻並搓揉至油亮光滑的程度,細小的四氧化三鐵粉末很容易被磁鐵吸引。
原理和概念
磁力異形的製作原理主要是高分子聚合物之間的交聯反應(cross-linking)。以下分別詳細地說明相關的反應與作用。
● 白膠與硼砂的交聯作用:白膠的主要成分是聚醋酸乙烯酯(polyvinyl acetate, PVAc),化學式為(C4H6O2)n,其單體為醋酸乙烯酯,是一種有彈性的高分子加成聚合物,廣泛用於木材、印刷裝訂和書籍藝術的黏著劑,其結構容易與透明膠水的主要成分-聚乙烯醇(polyvinyl alcohol, PVA)相混淆;而硼砂(borax)在水中會形成硼酸根離子,三者的結構式,分別如圖六所示:
化學教室活動:製作磁性異形(How to Make Magnetic Alien)〔I〕
國立大甲高級中學化學科廖旭茂老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義(Student Handout)
磁性異形簡介
本實驗活動係利用白膠的主要成分-聚醋酸乙烯酯(polyvinyl acetate, PVAc)取代製作異形或QQ球的透明膠水主要成分-聚乙烯醇(polyvinyl alcohol, PVA)。在透明膠水中,加入不等量的飽和硼砂水溶液,使高分子鏈之間產生交聯作用(cross-linking),以降低它的流動性。在加入氧化鐵黑(ferroferric oxide)粉末後,充分攪拌均勻,形成「異形」。利用強力磁鐵進行演示,結果發現「異形」能被強力磁鐵吸引,且能靈活伸展移動,模樣仿如外星生物(亦稱磁力異形),讓學生感受驚奇有趣,甚至連大人也張目咋舌,愛不釋手。
透過教育部化學學科中心種子教師工作坊培訓活動、化學闖關教師工作坊以及縣市夥伴的研習,「製作磁力異形」有機會推廣與分享到全國各高中,如中山女高、竹山高中和高雄中學等學校,約有250位化學教師參與磁力異形的製作工作坊,並且獲得多數老師的贊同與肯定;除此之外,磁力異形亦應用於高三學生有機高分子的實驗教學,深受學生喜愛。分享「製作磁力異形」工作坊的活動照片,如圖一所示。
本文除描述磁性異形的製作方法外,也提供其有趣的演示戲法和自製的影片,並且詳細地說明此實驗所涉及的原理與概念。
化學教室活動:利用樂高製作簡易光電比色計(Making Simple Spectrophotometer using LEGO)〔IV〕
國立豐原高級中學化學科蔡亞柏退休教師 / 國立彰化師範大學化學系楊水平副教授責任編輯
請按此連結,參閱「化學教室活動:利用樂高製作簡易光電比色計〔III〕」
D. 繪製檢量線:用MS-Excel繪製檢量線
化學教室活動:利用樂高製作簡易光電比色計(Making Simple Spectrophotometer using LEGO)〔III〕
國立豐原高級中學化學科蔡亞柏退休教師 / 國立彰化師範大學化學系楊水平副教授責任編輯
請按此連結,參閱「化學教室活動:利用樂高製作簡易光電比色計〔II〕」
利用簡易光電比色計測定未知濃度的溶液
A. 實驗原理
化學教室活動:利用樂高製作簡易光電比色計(Making Simple Spectrophotometer using LEGO)〔II〕
國立豐原高級中學化學科蔡亞柏退休教師 / 國立彰化師範大學化學系楊水平副教授責任編輯
請按此連結,參閱「化學教室活動:利用樂高製作簡易光電比色計〔I〕」
製作簡易光電比色計
B. 利用樂高積木製作比色槽
化學教室活動:利用樂高製作簡易光電比色計(Making Simple Spectrophotometer using LEGO)〔I〕
國立豐原高級中學化學科蔡亞柏退休教師 / 國立彰化師範大學化學系楊水平副教授責任編輯
實驗簡介
本實驗的目的是讓學生利用LEGO NXT 9797(樂高套件主機)、LEGO 9844 light sensor(樂高光感測器)及LEGO Building Block(樂高積木),自製簡易光電比色計,如圖一所示,其中感測器被放置在以樂高積木組裝的比色槽中。透過配製五個已知濃度的標準溶液,以及MS-Excel軟體製作出檢量線,來測定有色溶液的未知濃度。透過此次實驗的實作,讓學生學習光電比色計所涉及的光電原理及探討LEGO NXT在化學實驗之應用。
化學教室活動:利用化學平板探索電解(Exploring Electrolysis using ChemPad)〔IV〕
國立大甲高級中學化學科廖旭茂老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
請按此連結,參閱「教師指引之二」
教師指引之三(Teacher’s Guide III)
影音連結
化學教室活動:利用化學平板探索電解(Exploring Electrolysis using ChemPad)
教學提示
化學教室活動:利用化學平板探索電解(Exploring Electrolysis using ChemPad)〔III〕
國立大甲高級中學化學科廖旭茂老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
請按此連結,參閱「教師指引之一」
教師指引之二(Teacher’s Guide II)
影音連結
化學教室活動:利用化學平板探索電解 (Exploring Electrolysis using ChemPad)〔I〕
國立大甲高級中學化學科廖旭茂老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義 (Student Handout)
影音連結:化學教室活動:利用化學平板探索電解
在此教室活動中,你將使用老師事先製作完成的化學平板(ChemPad),進行有趣的電解實驗。化學平板包含一個電解平板及兩支電解筆(不鏽鋼線和銅線)。電解平板的設計,外觀是一個相框,材質是木製或不銹鋼,底面是一塊金屬板(不鏽鋼和鋁板),上面鋪上一張濕潤的水彩紙(或不織布),一個電池及電流切換開關嵌入相框的背面。利用化學平板,及不同材質的電解筆,於水彩紙(或不織布)上,噴上電解液和酸鹼指示劑,即可在課堂上進行一系列的氧化還原反應、酸鹼中和及錯合反應等典型的化學實驗。化學平板可多次重複使用、藥品減量達95%以上,符合綠色環保的原則。兩款不同材質的化學平板的示意圖,如圖一所示。本活動你將使用不銹鋼製作的化學平板進行電解實驗,圖二為利用不銹鋼盤製作化學平板的背面組裝零件。
化學教室活動:利用化學平板探索電解 (Exploring Electrolysis using ChemPad)
國立大甲高級中學化學科廖旭茂老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
實驗介紹
在此教室活動中,你將使用事先製作完成的化學平板(ChemPad),進行有趣的電解實驗。利用化學平板,及不同材質的電解筆,於水彩紙(或不織布)上,噴上電解液和酸鹼指示劑,即可在課堂上進行一系列的氧化還原反應、酸鹼中和及錯合反應等典型的化學實驗。化學平板可多次重複使用、藥品減量達95%以上,符合綠色環保的原則。
化學教室活動:維他命C含量的微量測定(Microscale Determination of Vitamin C by Iodine Titration)〔IV〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊(Teacher’s Guide)
教學提示
● 上課時間:教師實驗解說:約15分鐘,學生自製微量滴定管:約10分鐘,學生自製小型電磁攪拌器:約20分鐘,學生實驗操作和數據記錄:約40分鐘。學生 數據處理和回答問題(家庭作業或課堂討論):約30分鐘。若微量滴定管和小型電磁攪拌器由教師組裝,可以節省上課時間約30分鐘。
● 本實驗可配合高二化學氧化還原滴定單元實施。學生自製微量滴定管和自製小型電磁攪拌器可以融入生活科技課程和物理課程的教學中。
● 請教師提醒學生預先以蒸餾水代替優碘溶液,以熟練自製微量滴定管的操作技巧。
● 自製小型電磁攪拌器的轉速快慢可透過調整電路中的可變電阻來完成。在滴定時,若無此攪拌器,則可以用咖啡攪拌匙或塑膠筷等當作玻棒,以手動方式攪拌滴定的溶液。
● 由於本次使用滴定的裝置並非實驗室正規的裝置,因此本實驗的精確度和準確度較低,但是若仔細地操作,則最後的抗壞血酸的含量可以得到三位有效數字。
● 本實驗的待測樣品可考慮使用市售的維他命C錠、柳橙或橘子果汁。
化學教室活動:維他命C含量的微量測定(Microscale Determination of Vitamin C by Iodine Titration)〔III〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之三(Student Handout III)
藥品和器材
1. 自製微量滴定管 1套/組
2. 自製小型電磁攪拌器(含磁攪拌子) 1套/組
3. 澱粉指示劑(配製請見教師手冊) 1 mL/組
4. 蒸餾水(裝在洗瓶內) 1瓶/組
5. 優碘溶液(如圖十六所示) 10 mL/組
6. 維他命C沖飲包(如圖十六所示) 1包/組
7. 小型塑膠容器(或PE秤量皿) 1個/組
8. 燒杯或紙杯(300 mL) 2個/組
9. 量筒(瘦長型,容量10 mL,精確度0.01 mL) 2個/組
10. 量筒(容量100 mL,精確度0.1 mL)或容量瓶 1個/組
11. PE滴管 2支/組
12. 塑膠筷(或玻棒、咖啡攪拌匙) 1支/組
化學教室活動:維他命C含量的微量測定(Microscale Determination of Vitamin C by Iodine Titration)〔II〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之二(Student Handout II)
B. 自製微量滴定管
B3. 操作說明
1. 在滴定前,微量滴定管和注射針筒需要潤洗,先以蒸餾水清洗2~3次後,再用滴定液潤洗2~3次。
2. 在吸取滴定液之前,先關閉三通塑膠活栓(圖六的左圖),再移岀注射針筒(圖六的右圖)。
3. 接著,先用注射針筒吸取約10 mL的滴定液(圖七的左圖),再緊密地插入三通塑膠活栓的左側孔(圖七的右圖)。
化學教室活動:維他命C含量的微量測定(Microscale Determination of Vitamin C by Iodine Titration)〔I〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之一(Student Handout I)
實驗介紹
本實驗採用微量化學實驗,在進行氧化還原滴定之前,學生或教師事先組裝簡易滴定架、自製微量滴定管和自製小型電磁攪拌器(圖一的左圖和右圖),作為氧化還原滴定的裝置。以市售的優碘液中的有效碘及玉米粉所製成澱粉指示劑,進行碘直接滴定法,來測定市售的維他命C沖飲包中含抗壞血酸的毫克
市售維他命C沖飲包中的主要成份為抗壞血酸(L-ascorbic acid, C6H8O6),是一種還原劑,容易被氧化成去氫型的抗壞血酸(dehydro-L-ascorbic acid, C6H6O6),因此可考慮以I2為氧化劑,對維他命C進行氧化還原滴定,來測定此沖飲包中抗壞血酸的含量,其反應如反應式[1a]和[1b]所示:
I2(aq) + C6H8O6(aq) → 2I–(aq) + 2H+(aq) + C6H6O6(aq) [1a]
化學教室活動:利用粉筆進行電解實驗(Electrolysis using Chalk)〔III〕
國立彰化女子高級中學化學科陳琬菁老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊(Teacher’s Guide)
教學提示
● 上課時間:教師實驗解說:約15分鐘,學生粉筆鑽孔:約5分鐘,學生實驗操作和實驗紀錄約65分鐘。討論與分享:約15分鐘。
● 本實驗所用的粉筆為傳統的粉筆,其成分為硫酸鈣,這是因為此種粉筆的孔隙較大,容易吸附電解液,而且也容易鑽孔洞。粉筆鑽孔洞亦可用鑽孔器和尖銳的筆尖等,但不可施力過大而造成粉筆鑽孔的破裂。
● 以鉛筆的筆芯當作電極,電解硫酸銅溶液的反應十分緩慢。以銅線當作電極,反應較快,推測可能以銅為電極,陽極失去電子產生Cu2+,因此溶液中有較多Cu2+,以利於陰極得電子析出金屬銅。電解硫酸銅溶液不宜電解太久,易產生黑色氧化銅。
● 以鉛筆的筆芯當作電極,此筆芯可選用2B扁型筆芯,折取所需長度,十分方便且省時。
● 本實驗使用粉筆當作電解裝置取代傳統的U型電解裝置,有以下的優點:(1)粉筆極易取得又方便操作,整組裝置輕巧,可節省許多空間。(2)在藥品需求方面,粉筆體積小,只需少量的浸泡溶液,同時浸泡數支粉筆,可節省許多藥品,以及降低CuSO4溶液等廢液回收的問題。(3)以電解碘化鉀溶液為例,負極可明顯觀察到粉筆呈現粉紅色;正極可清楚看到紫黑色的固體,以澱粉液檢驗,確認其為碘。電解後剖半粉筆,可觀察到於負極呈現的粉紅色(OH-)及正極呈現的棕色(I3-)。
化學教室活動:利用粉筆進行電解實驗(Electrolysis using Chalk)〔II〕
國立彰化女子高級中學化學科陳琬菁老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之二(Student Handout II)
實驗步驟
C. 電解硫酸鈉水溶液
1. 先使用一支美工刀切斷一根白色粉筆成等長的粉筆,再使用一支合適大小的一字形螺絲起子在粉筆的兩端鑽孔,深度約0.5。然後在兩端約0.5 cm處各鑽一個氣孔,深度約0.3 cm。
2. 在一杯約20 mL的飽和硫酸鈉水溶液中,加入約1 mL廣用指示劑。浸泡已鑽孔的粉筆在此水溶液中,待整支粉筆潤濕後取出,如圖八所示。註:兩組共用,一組一支即可。
化學教室活動:利用粉筆進行電解實驗(Electrolysis using Chalk)〔I〕
國立彰化女子高級中學化學科陳琬菁老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之一(Student Handout I)
實驗介紹
粉筆在日常生活中可輕易獲得,看似平凡無奇的粉筆,其實可以巧妙地應用在化學實驗上。本實驗以粉筆當作電解裝置,以電池代替電源供應器,進行簡易的電解實驗,如圖一所示。此電解實驗除了可觀察到預測的結果之外,最大的優點是節省藥品及攜帶方便。
化學教室活動:食用色素和螢光筆色素的濾紙色層分析(Paper Chromatography)[III]
國立彰化師範大學化學系學生方浩羽 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊(Teacher’s Guide)
教學提示
● 上課時間:教師解說實驗原理:約10分鐘,教師介紹實驗步驟:約15分鐘,學生組合實驗裝置並進行濾紙色層分析:約35分鐘。實驗記錄並觀察色素和染料的數目:約25分鐘。家庭作業(回答問題):約15分鐘。
● 實驗時,老師要提醒學生濾紙圓心處的孔洞不可太大,心蕊必須剛好緊密地與濾紙結合。若孔洞太大,則會使溶劑展開不順利,而造成色層歪斜(非圓形)的狀況。
● 一般含有深顏色的食物含有食用色素,例如MM巧克力和酸梅。雖然展開的顏色比較淡,拍照無法看到明顯的色層,但是可以用肉眼觀察到是否為單一色素。
● 教師也可以安排多餘的時間(如專題研究或社團活動),讓學生嘗試使用其他的展開溶劑或溶劑對,繼續進行食用色素、螢光筆和其他含色素物質的濾紙色層分析。
● 本實驗為無安全顧慮以及對環境低污染,除可在教室進行之外,學生也可以在家長的監督下在家裡進行。
化學教室活動:食用色素和螢光筆色素的濾紙色層分析(Paper Chromatography)[II]
國立彰化師範大學化學系學生方浩羽 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之二(Student Handout II)
實驗步驟
一、食用色素分離
1. 教師上課時,放置配製好的高濃度食用色素溶液在講桌上,供全班使用。這些食用色素溶液可能為單一種的或混合多種的食用色素所配製而成的。使用每一燒杯分配的一支牙籤沾取食用色素,務必不可混用而交叉污染。
2. 取一片110 mm的濾紙,在圓心處利用一支牙籤鑽出一個直徑約2 mm的小圓洞。然後到講桌前,利用指定的一支牙籤沾食用色素溶液,點滴在小圓洞附近,形成色素的圓點直徑約1 cm,並利用吹風機吹乾,如圖四所示。若食用色素的顏色很淡,則在吹乾後,再利用相同一支的牙籤點滴色素,重複兩到三次以增加顏色的深度。
化學教室活動:食用色素和螢光筆色素的濾紙色層分析(Paper Chromatography)[I]
國立彰化師範大學化學系學生方浩羽 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之一(Student Handout I)
實驗介紹
在日常生活中,我們常常接觸到色素和染料,例如:食物裡添加食用色素、染頭髮的染劑、彩色書本和雜誌的印刷顏料、廣告顏料、原子筆和麥克筆的墨水,這些有顏色的物質是單一種色素或是混合物呢?你想知道市售螢光筆(圖一)是多種螢光色素所組成的嗎?
感謝報名參加高瞻計畫中學教學資源平台結案成果發表會,提醒您以下資訊,屆時歡迎您的蒞臨與指教!
一、時間:民國100年8月22日 (星期一)
二、地點:台大化學系一樓松柏講堂 –> 由於化學系館周遭適逢施工,所以特此附上更仔細的說明路線與照片提供給各位師長參考 (請參閱地圖路線)
三、當天報到時間為 9:20-10:00
四、當天開車自行前來的老師們,務必於正門口停車取票 (停車卷)
五、若老師臨時決定要開車前來 (當初於報名系統未註明) –> 要煩請老師來信或來電告知我們一聲喔!
有任何相關問題,都可來信或來電02-33661660詢問!
![]() 高瞻計畫中學教學資源平台結案成果發表會-活動邀請函、活動議程、講員簡介、活動相關事宜!
高瞻計畫中學教學資源平台結案成果發表會-活動邀請函、活動議程、講員簡介、活動相關事宜!
化學教室活動:神奇的超吸水聚合物 (Magic Super Absorbent Polymers)〔III〕
國立彰化女子高級中學化學科陳琬菁老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊之二 (Teacher’s Guide II )
藥品配製
1. 1 M鹽酸:取1mL的12 M濃鹽酸加水稀釋至總體積12 mL。
2. 1 M氫氧化鈉溶液:取0.4 g的氫氧化鈉溶於水,使總體積10 mL。
3. 酚酞(Phenolphthalein)指示劑:溶解0.5克的酚酞在50 mL的95%酒精中,再加50 mL的水,混合均勻。
4. 溴瑞香草藍(Bromothymol blue)指示劑:溶解0.1克的溴瑞香草藍在100毫升的 20%酒精中。
5. 1 M糖水:取32.4 g的蔗糖溶於水,形成100 mL水溶液。
6. 1 M食鹽水:取58.5 g的食鹽溶於水,形成100 mL水溶液。
7. 飽和食鹽水:在200 mL的水中加入食鹽,直到不再溶解為止,取澄清液。
化學教室活動:神奇的超吸水聚合物 (Magic Super Absorbent Polymers)〔II〕
國立彰化女子高級中學化學科陳琬菁老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊之一 (Teacher’s Guide I )
化學示範
在學生進行實驗之前,老師示範「水到哪去了」的主要目的是,藉由觀察類似魔術般驚奇有趣的事件,引起學生對於吸水聚合物更進一步有興趣的探討。
A. 器材和溶液
1. 透明塑膠杯 3個
2. 紙杯 3個
3. 聚丙烯酸鈉(Sodium polyacrylate) 少許
4. 1 M鹽酸(1 M Hydrochloric acid) 少許
5. 1 M氫氧化鈉(1 M Sodium hydroxide) 少許
6. 酚酞指示劑(Phenolphthalein indicator) 少許
7. 溴瑞香草藍指示劑(Bromothymol blue indicator) 少許
8. PE滴管 4支
9. 刮勺 1支
化學教室活動:神奇的超吸水聚合物 (Magic Super Absorbent Polymers)〔I〕
國立彰化女子高級中學化學科陳琬菁老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義 (Student Handout)
化學示範
老師示範「水到那兒去了」,學生觀察顏色變化的現象,並與學生互動討論水到那兒去了。
實驗介紹
本次實驗的目的是探討超吸水聚合物(Super Absorbent Polymers, SAP)聚丙烯酸鈉(sodium polyacrylate)的滲透作用、尿布內聚丙烯酸鈉的吸水倍數、以及玩具恐龍吸水的膨脹率。圖一為尿布含內聚丙烯酸鈉的位置圖。
化學教室活動:製作巴克球的串珠模型 (Making Beaded Buckyball Model)〔III〕
國立臺中第一高級中學化學科薛朋雨老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
製作前講解
教師手冊 (Teacher’s Guide)
此活動的教學投影片包含製作C20和C60的串珠模型。
附件一(製作C20串珠模型):![]() C20 Classroom Activity PowerPoint.pdf (1.19 MB)
C20 Classroom Activity PowerPoint.pdf (1.19 MB)
附件二(製作C60串珠模型):![]() C60 Classroom Activity PowerPoint.pdf (1.13 MB)
C60 Classroom Activity PowerPoint.pdf (1.13 MB)
動畫和影片
● 觀賞動畫影片,請按此連結:C60 Fullerene and Carbon Nanotube Interaction, YouTube.
化學教室活動:製作巴克球的串珠模型 (Making Beaded Buckyball Model)〔II〕
國立臺中第一高級中學化學科薛朋雨老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義二 (Student Handout II)
● 製作C60的詳細步驟
C60的四分層串珠數目之分析圖,如圖十三所示。
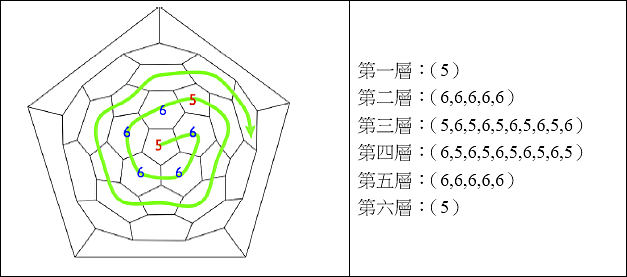
圖十三 C60的四分層之分析圖(圖片來源:Slides for making a beaded C60, http://thebeadedmolecules.blogsp … ing-beaded-c60.html)
第1步:右線加珠5顆 → 左線交叉第5顆珠成環 → 形成第一個五邊形(亦即五圓環的五個鍵結),如圖十四所示。
化學教室活動:製作巴克球的串珠模型 (Making Beaded Buckyball Model)〔I〕
國立臺中第一高級中學化學科薛朋雨老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之一 (Student Handout I)
活動介紹
本活動的目的為利用串珠製作分子模型來瞭解巴克球C20和C60的化學立體結構。
● 富勒烯與巴克球
富勒烯(Fullerenes)是完全由碳組成的中空的球型、橢圓型、柱型或管狀分子的總稱。球狀的富勒烯也被稱為巴克球,類似於用於足球協會的足球,如圖一所示。圓柱狀的富勒烯被稱為碳納米管(carbon nanotubes)或巴克管(buckytubes)。富勒烯在結構上類似石墨,它是由堆疊石墨片連結成六角環,但它們可能還包含五邊形(有時七邊形)環。富勒烯是繼金剛石和石墨之後,於1985年發現的碳元素的第三種晶體形態。碳60(C60)和碳70(C70)是較常見的兩種巴克球,也是目前技術上能夠量產的富勒烯。
化學教室活動:自製簡易光電比色計(Homemade Simple Spectrophotometer)〔IV〕
國立豐原高級中學化學科蔡亞柏老師/國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊之二(Teacher’s Guide II)
實驗紀錄樣本
A. 實驗數據紀錄於表二,並進行數據處理。
本次實驗設定IC = 5 mA。
化學教室活動:自製簡易光電比色計(Homemade Simple Spectrophotometer)〔III〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊之一(Teacher’s Guide I)
背景資料
A. LED測試盒
整組儀器除了定電流LED驅動電路需仔細配線外,其他很容易按「學生手冊」的說明組裝。在定電流LED驅動電路方面,可以考慮以市售LED測試盒代替自己組裝。一個LED測試盒價格約250元,可到電子街詢問,作者購自台中廣華電子。
按照圖一的順序連接,先選擇定電流值(2~30 mA,下圖係選用30 mA進行連接)後,再連接一個藍光LED,便完成定電流驅動電路。
化學教室活動:自製簡易光電比色計(Homemade Simple Spectrophotometer)〔II〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之二(Student Handout II)
實驗步驟
B. 實驗操作流程圖
1. 放置比色管到比色槽中,並用一顆樂高積木(2 × 4)予以加蓋,如圖十二所示。
化學教室活動:自製簡易光電比色計(Homemade Simple Spectrophotometer)〔I〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之一(Student Handout I)
實驗介紹
本實驗的目的是藉由自製簡易的光電比色計,透過數個等差級數濃度的標準液,以及Excel軟體製作檢量線,來探討有色溶液濃度的測定。再者,藉由此機會,學習光電比色計所涉及的光電原理。
在高中化學課本裡,提及有色溶液的顏色越深,其濃度越濃。這僅僅是定性關係的描述。在此次的活動中,經由自製簡易的光電比色計及進行實驗,更深入地探討有色溶液的濃度與顏色深淺之定量關係。